文章來源:六月行研社
藥苑雜談?YAOYUANZATAN
藥物臨床試驗期間、藥品上市后都可以提出新增適應癥的申請,本文總結了幾種常見的新增適應癥的情形,從法規依據和注冊路徑兩方面概述,希望對大家有所啟發和幫助,但可能存在考慮不周全的地方,歡迎各位同行指正。
情形一:臨床試驗期間,提出新增適應癥
法規依據一:《藥品注冊管理辦法》

法規依據二:《化學藥品注冊受理審查指南》(第一部分 注冊分類1、2、5.1類)

對于新藥,同一藥物如有多個適應癥,按照一個適應癥對應一個IND/NDA提交注冊申請;雖然受理審查指南對于仿制藥(注冊分類3、4、5.2類的產品)未作相關說明,但如果仿制的參比制劑有多個適應癥,也應分別提交注冊申請。
注冊路徑:IND+NDA/ANDA。
藥品上市后新增適應癥主要分為三種情況:
1)新增的適應癥為境內已批準的,即國內同品種已批準的適應癥(見情形二);
2)新增的適應癥為境外已批準但境內未批準的,此處已上市藥品包括仿制藥和新藥(分別見情形三、情形四);
3)新增的適應癥為境內和境外均未獲批的(情形五);
情形二:藥品上市后,新增的適應癥為境內
已批準的,即國內同品種已批準的適應癥
法規依據一:《已上市化學藥品和生物制品臨床變更技術指導原則》


法規依據二:CDE常見一般性技術問題
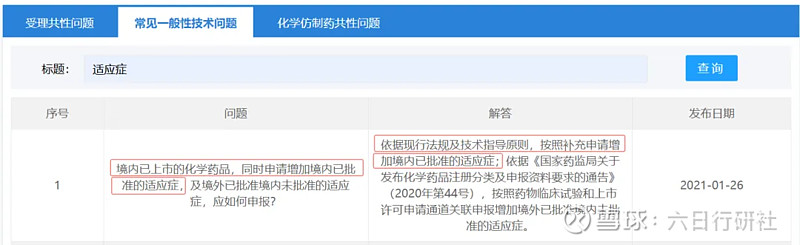
根據法規要求,情形二屬于重大變更,需要提交補充申請并經過審評、審批后執行。因新增的適應癥為國內同品種已批準的,那么這個適應癥的安全性和有效性是明確的。對于普通口服固體制劑,如果能做到藥學一致、BE等效的話,大概率是不需要開展驗證性臨床。但如果是復雜制劑,比如復雜的注射劑,可能很難豁免,需具體問題具體分析。
注冊路徑:藥品上市許可持有人在開展臨床試驗前,應首先提出補充申請,在獲得批準后方可開展臨床試驗。藥品上市許可持有人完成臨床試驗并經評估認為試驗數據可支持相應變更時,可向國家藥品監督管理局遞交補充申請。
情形三:藥品上市后(仿制藥),
新增的適應癥為境外已批準但境內未批準的
法規依據一:《化學藥品注冊受理審查指南》(第二部分 注冊分類3、4、5.2類)

法規依據二:CDE常見一般性技術問題

注冊路徑:IND+ANDA(3類)
情形四:藥品上市后(新藥),
新增的適應癥為境外已批準但境內未批準的
法規依據:《化學藥品注冊受理審查指南》(第一部分 注冊分類1、2、5.1類)

注冊路徑:IND+NDA(5.1類)
情形五:藥品上市后,
新增的適應癥為境內和境外均未獲批的
法規依據:《化學藥品注冊受理審查指南》(第一部分 注冊分類1、2、5.1類)

注冊路徑:IND+NDA(2.4類)






 滬公網安備31010402000451號
滬公網安備31010402000451號